科學家發現慢(màn)性低度炎症的(de)遺傳位點
慢(màn)性炎症是對(duì)刺激劑、損傷或失調性急性炎症的(de)長(cháng)期炎症反應。慢(màn)性低度炎症與許多(duō)複雜(zá)疾病有關,包括癌症、心血管疾病(CVD)、呼吸系統疾病,自身免疫性疾病和(hé)内分(fēn)泌代謝疾病。然而,将慢(màn)性低度炎症與慢(màn)性疾病聯系起來(lái)的(de)潛在分(fēn)子途徑知之甚少。C-反應蛋白(CRP),一種主要由肝髒産生的(de)急性期蛋白,已被确定爲全身炎症的(de)标志物(wù)。環境和(hé)遺傳因素對(duì)血清 CRP水(shuǐ)平有重大(dà)影(yǐng)響。在前期的(de)遺傳關聯研究中,已經确定了(le)58個(gè)獨特的(de)位點,使用(yòng)來(lái)自約200,000名歐洲人(rén)的(de)數據,解釋了(le)約7%的(de)CRP水(shuǐ)平變異。盡管如此,這(zhè)種複雜(zá)特征的(de)遺傳結構仍沒有得(de)到很好的(de)表征。近日,來(lái)自英國倫敦帝國理(lǐ)工學院的(de)研究學者在Nat Commun上發表了(le)一篇題爲“Genetic analysis of over half a million people characterises C-reactive protein loci”的(de)研究論文,解開了(le)循環CRP水(shuǐ)平的(de)潛在遺傳成分(fēn)可(kě)以闡明(míng)CRP參與疾病過程的(de)機制,發現了(le)調節炎症的(de)潛在治療靶點。
在該研究中,研究人(rén)員(yuán)報告了(le)關于CRP水(shuǐ)平的(de)最大(dà)的(de)全基因組關聯研究(GWAS),使用(yòng)的(de)數據來(lái)自英國生物(wù)庫(UKB)和(hé)基因組流行病學中的(de)心髒和(hé)衰老研究隊列(CHARGE)聯盟。此外,他(tā)們進行了(le)一系列GWAS後的(de)分(fēn)析,以闡明(míng)研究結果的(de)功能特點,并突出潛在途徑。最後,他(tā)們進行了(le)全表型關聯研究(PheWAS),從宏觀上研究慢(màn)性炎症的(de)臨床後果,并輔以孟德爾随機化(huà)(MR)分(fēn)析來(lái)評估因果關系。
通(tōng)過對(duì)英國生物(wù)樣本庫參與者(N = 427,367,歐洲血統)和(hé)基因組流行病學(CHARGE)聯盟(總N = 575,531歐洲血統)中關于全身炎症标志物(wù)C反應蛋白(CRP)的(de)最大(dà)全基因組關聯研究(GWAS),他(tā)們确定了(le)266個(gè)獨立位點,其中211個(gè)以前沒有被報道過。基因集分(fēn)析突出了(le)42個(gè)與CRP水(shuǐ)平相關的(de)基因集(p ≤ 3.2×10−6)和(hé)組織表達分(fēn)析表明(míng)CRP相關基因與肝髒和(hé)全血基因表達有很強的(de)相關性。表型組範圍關聯研究确定了(le)27項與遺傳确定的(de)CRP相關的(de)臨床結局,随後的(de)孟德爾随機化(huà)分(fēn)析結果支持與精神分(fēn)裂症,慢(màn)性氣道阻塞和(hé)前列腺癌的(de)因果關系。
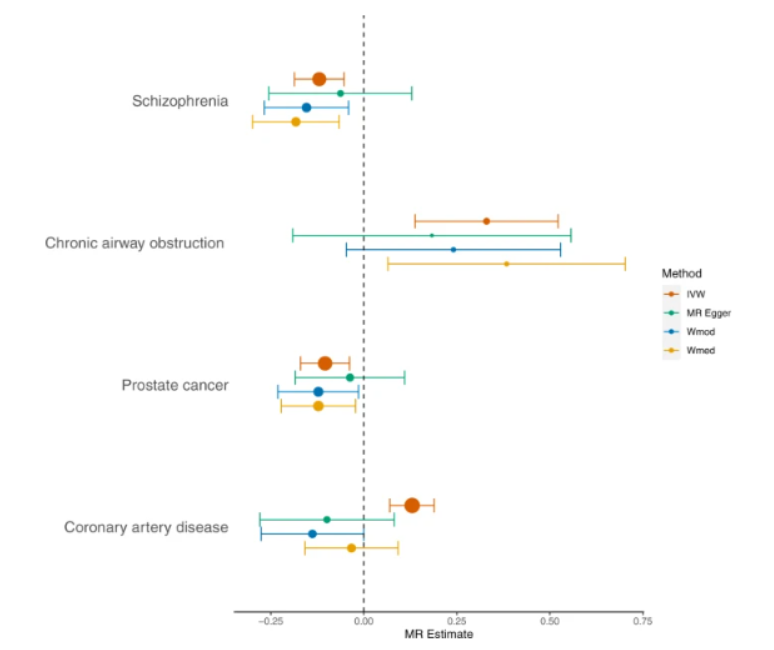
總之,該研究結果确定了(le)慢(màn)性低度炎症的(de)遺傳位點和(hé)功能特性,并爲與一系列疾病的(de)因果關系提供了(le)證據。
新研究表明(míng)化(huà)合物(wù)RP-6306有望治療發生CNE1擴增的(de)癌症
在一項新的(de)臨床前研究中,來(lái)自加拿大(dà)多(duō)倫多(duō)西奈山醫院、多(duō)倫多(duō)大(dà)學和(hé)美(měi)國Repare Therapeutics公司的(de)研究人(rén)員(yuán)發現一種旨在阻斷某些癌細胞生存所必需的(de)PKMYT1激酶的(de)新藥物(wù)顯示出遏制腫瘤生長(cháng)的(de)前景。相關研究結果發表在2022年4月(yuè)28日的(de)Nature期刊上,論文标題爲“CCNE1 amplification is synthetic lethal with PKMYT1 kinase inhibition”。

這(zhè)種稱爲RP-6306的(de)新藥物(wù)是多(duō)倫多(duō)西奈山醫院盧恩菲爾德-塔倫鮑姆研究所(LTRI)高(gāo)級研究員(yuán)Daniel Durocher及其團隊在進行基于CRISPR-Cas9基因編輯技術的(de)合成緻死性篩選過程中設計出來(lái)的(de)。它是一種口服的(de)生物(wù)可(kě)利用(yòng)的(de)選擇性抑制劑,可(kě)選擇性抑制PKMYT1。
這(zhè)些作者确定了(le)對(duì)發生CCNE1擴增的(de)癌細胞的(de)生存能力至關重要的(de)基因。癌細胞發生CCNE1擴增是一些難以治療的(de)卵巢癌、子宮内膜癌和(hé)膀胱癌的(de)典型特征。他(tā)們發現PKMYT1在發生CCNE1擴增的(de)癌細胞中是必不可(kě)少的(de),但在其他(tā)的(de)健康細胞中卻不是如此。在與精準腫瘤學公司Repare Therapeutics的(de)合作中,他(tā)們開發出一種名爲RP-6306的(de)藥物(wù),它能阻斷PKMYT1的(de)活性并有效地殺死發生CCNE1擴增的(de)癌細胞。Durocher說,“這(zhè)些癌細胞依賴PKMYT1生存。我們的(de)臨床前數據顯示,藥物(wù)RP-6306靶向這(zhè)些類型的(de)腫瘤并顯著抑制腫瘤生長(cháng)的(de)能力顯示出巨大(dà)的(de)前景。”目前,發生CCNE1擴增的(de)癌症很少有治療選擇。Repare Therapeutics公司的(de)高(gāo)級科學家David Gallo說,他(tā)們能夠證實RP-6306既有效力又有選擇性,可(kě)以在人(rén)體中口服使用(yòng)。
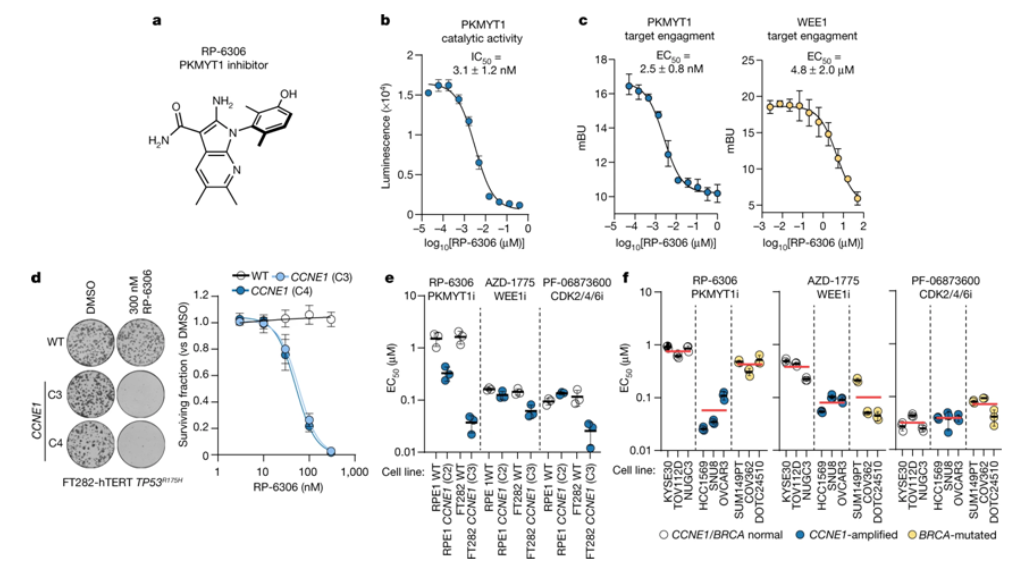
RP-6306是一種選擇性PKMYT1抑制劑,在發生CCNE1擴增的(de)癌細胞中具有活性
Gallo說,“衆所周知,發生CCNE1擴增的(de)婦科腫瘤和(hé)其他(tā)實體瘤對(duì)目前的(de)标準治療方法有抵抗性。現在迫切需要爲這(zhè)些患者找到新的(de)治療方案。”這(zhè)項研究是Durocher實驗室和(hé)Repare Therapeutics公司之間的(de)緊密合作的(de)結果。Durocher于2016年與Frank Sicheri一起創立了(le)Repare Therapeutics公司。Durocher說,“我們的(de)團隊與Repare Therapeutics公司之間的(de)這(zhè)種緊密合作突出了(le)工業界和(hé)學術界如何能夠共同爲癌症患者發現新的(de)治療方案。在啓動一項臨床試驗的(de)同時(shí)發布一種新的(de)靶标是很罕見的(de)。這(zhè)充分(fēn)說明(míng)了(le)這(zhè)種合作的(de)創新能力。”Repare Therapeutics公司已在發生CCNE1擴增的(de)實體瘤患者中啓動了(le)I期臨床試驗,預計将在2022年底獲得(de)初步結果。
揭示G蛋白偶聯受體介導的(de)β-arrestin激活機制
在美(měi)國食品藥品管理(lǐ)局(FDA)批準的(de)所有藥物(wù)中,大(dà)約有三分(fēn)之一的(de)藥物(wù)靶向一個(gè)大(dà)型的(de)生物(wù)分(fēn)子家族,即所謂的(de)G蛋白偶聯受體(GPCR),GPCR的(de)職責是觸發細胞對(duì)胞外刺激的(de)反應。人(rén)體中存在800多(duō)種不同的(de)GPCR,并在無數種疾病的(de)病理(lǐ)和(hé)治療中發揮作用(yòng),包括癌症、2型糖尿病、肥胖、睡(shuì)眠障礙、精神分(fēn)裂症和(hé)抑郁。如今,來(lái)自多(duō)個(gè)研究機構的(de)研究人(rén)員(yuán)對(duì)GPCR的(de)作用(yòng)機制有了(le)新的(de)認識,這(zhè)是朝著(zhe)開發具有較少副作用(yòng)的(de)改良藥物(wù)邁出的(de)一步。相關研究結果于2022年4月(yuè)27日在線發表在Cell期刊上,論文标題爲“GPCR-mediated β-arrestin activation deconvoluted with single-molecule precision”。

論文共同通(tōng)訊作者、哥(gē)倫比亞大(dà)學瓦格洛斯醫學院精神病學實驗治療學教授Jonathan A. Javitch博士說,“靶向GPCR的(de)藥物(wù)被用(yòng)來(lái)治療醫學上的(de)一系列疾病---心髒病、肺病、睡(shuì)眠和(hé)神經精神疾病,而且GPCR也(yě)負責嗅覺、味覺和(hé)視覺。”
但像許多(duō)治療方法一樣,靶向GPCR的(de)藥物(wù)往往有副作用(yòng),其中的(de)一些副作用(yòng)可(kě)能是嚴重的(de)。例如,靶向一組稱爲阿片受體(opioid receptor)的(de)GPCR的(de)藥物(wù)對(duì)治療疼痛非常有效,但也(yě)有危險的(de)副作用(yòng),如呼吸困難和(hé)便秘。目前,這(zhè)些化(huà)合物(wù)在靶向緩解疼痛的(de)信号通(tōng)路的(de)同時(shí)也(yě)會激活呼吸道信号通(tōng)路和(hé)腸道信号通(tōng)路。論文共同第一作者、哥(gē)倫比亞大(dà)學精神病學系臨床神經生物(wù)學助理(lǐ)教授Wesley B. Asher博士說,“在我們的(de)研究中,我們使用(yòng)的(de)方法使我們能夠以前所未有的(de)細節探究藥物(wù)刺激的(de)GPCR如何激活蛋白β-arrestin,β-arrestin既參與終止一些信号,又參與調解其他(tā)信号。我們的(de)最終目标是能夠開發出信号通(tōng)路特異性的(de)化(huà)合物(wù)。”這(zhè)項研究涉及使用(yòng)一種稱爲單分(fēn)子熒光(guāng)共振能量轉移(smFRET)成像的(de)前沿技術。該技術由論文共同通(tōng)訊作者、聖猶大(dà)兒(ér)童研究醫院的(de)Scott C. Blanchard博士推進,以無與倫比的(de)細節捕捉單個(gè)蛋白系統内的(de)運動。由于該方法能實時(shí)可(kě)視化(huà)觀察單個(gè)蛋白的(de)結構變化(huà),它能提供将樣本中大(dà)量蛋白平均化(huà)的(de)傳統方法無法獲得(de)的(de)新見解。利用(yòng)smFRET技術,這(zhè)些作者決定探測β腎上腺素能受體---一種與生物(wù)學的(de)許多(duō)不同領域廣泛相關的(de)典型GPCR。藥物(wù)或内源性激素與細胞外膜上的(de)β-腎上腺素能受體或其他(tā)GCPR結合,導緻細胞内部出現信号,這(zhè)些信号是由G蛋白的(de)激活介導的(de)。但是另一種類型的(de)蛋白---β-arrestin---的(de)結合終止了(le)這(zhè)種信号傳導,并能激活其他(tā)想要或不想要的(de)下(xià)遊途徑。通(tōng)過觀察β-arrestin被β腎上腺素能受體激活的(de)過程,這(zhè)些作者發現了(le)關于β-arrestin如何與β腎上腺素能受體相互作用(yòng)并被它激活的(de)新細節,這(zhè)些過程需要解除這(zhè)兩種蛋白的(de)自我抑制。
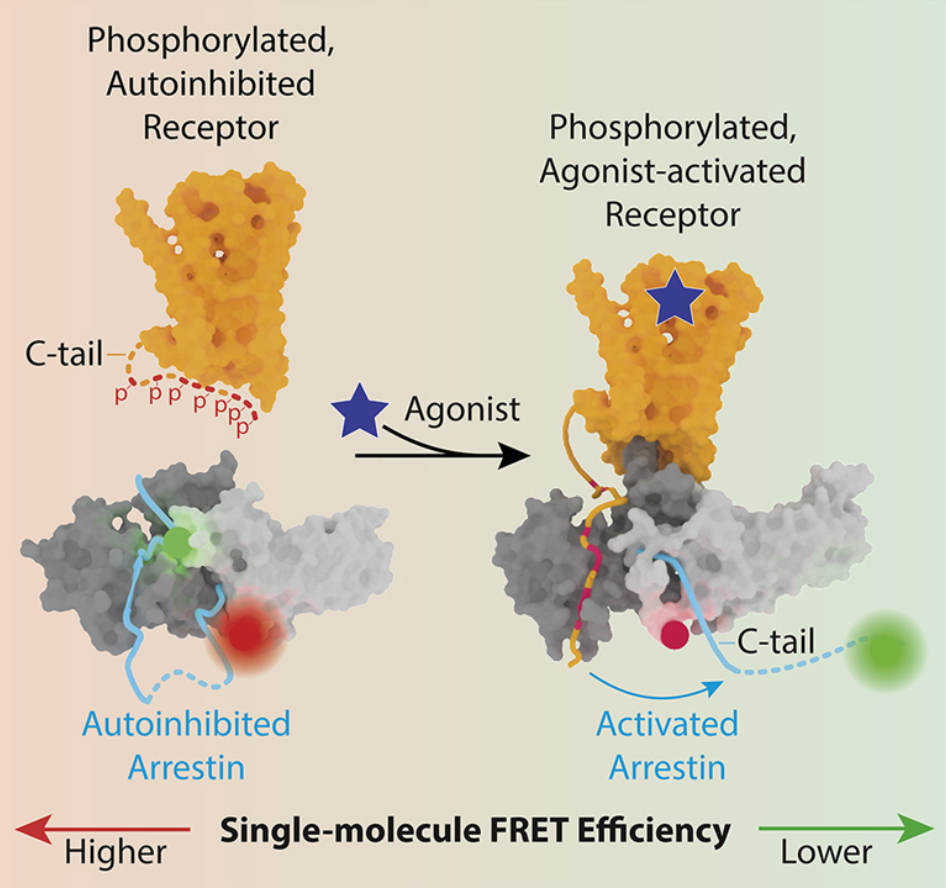
這(zhè)些發現最終可(kě)能有助于确定改進的(de)藥物(wù),以便它們通(tōng)過調節β-arrestin與β腎上腺素能受體的(de)結合和(hé)/或激活來(lái)影(yǐng)響特定途徑而不是其他(tā)途徑。
這(zhè)些研究結果還(hái)支持“條形碼假說(barcode hypothesis)”,即受體内不同的(de)磷酸化(huà)模式或“條形碼”可(kě)導緻不同的(de)β-arrestin激活模式,這(zhè)反過來(lái)又決定了(le)下(xià)遊的(de)信号傳導結果。這(zhè)些作者希望,更好地理(lǐ)解受體“條形碼”和(hé)β-arrestin激活之間的(de)關系,可(kě)以爲如何靶向特定的(de)下(xià)遊途徑而不是其他(tā)途徑,提供重要的(de)新見解。
重磅研究!開發出新型成像方法CATCH,可(kě)精确地在哺乳動物(wù)組織中鑒定藥物(wù)結合的(de)靶标
在一項新的(de)研究中,來(lái)自斯克裏普斯研究所的(de)研究人(rén)員(yuán)開發出一種可(kě)以在不同的(de)組織中以比以往更高(gāo)的(de)精度對(duì)藥物(wù)與身體中靶标結合的(de)地方進行成像的(de)方法。這(zhè)種新方法可(kě)能成爲藥物(wù)開發的(de)一個(gè)常規工具。相關研究結果于2022年4月(yuè)27日在線發表在Cell期刊上,論文标題爲“In situ identification of cellular drug targets in mammalian tissue”。
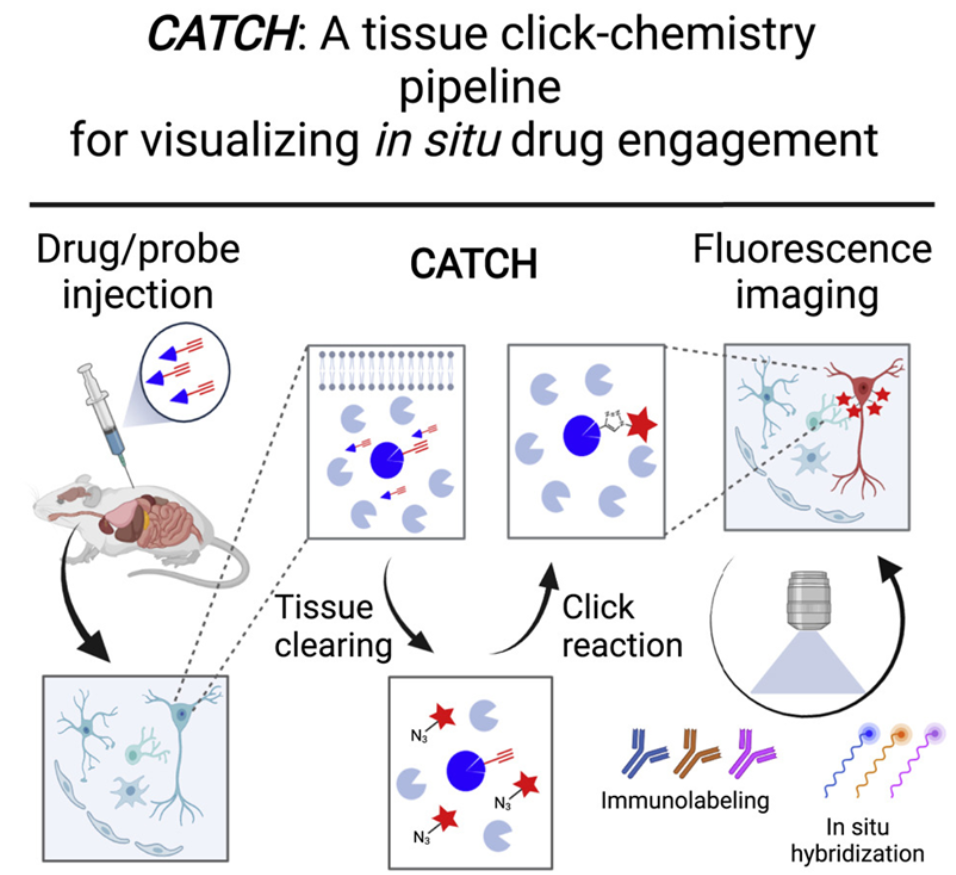
這(zhè)項研究描述了(le)這(zhè)種名爲透明(míng)輔助組織點擊化(huà)學(clearing-assisted tissue click chemistry, CATCH)的(de)新方法,它将熒光(guāng)标簽附著(zhe)在藥物(wù)分(fēn)子上,并使用(yòng)化(huà)學技術來(lái)改善熒光(guāng)信号。這(zhè)些作者利用(yòng)幾種不同的(de)實驗性藥物(wù)展示了(le)這(zhè)種方法,揭示了(le)這(zhè)些藥物(wù)分(fēn)子靶向結合它們的(de)靶标的(de)位置,而且即便在單個(gè)細胞中,也(yě)是如此。
論文通(tōng)訊作者、斯克裏普斯研究所神經科學助理(lǐ)教授Li Ye博士說,“這(zhè)種方法最終應該讓我們第一次相對(duì)容易地看到爲什(shén)麽一種藥物(wù)比另一種藥物(wù)更有效,或者爲什(shén)麽一種藥物(wù)有特定的(de)副作用(yòng)而另一種藥物(wù)沒有。”了(le)解藥物(wù)分(fēn)子在哪裏與它們的(de)靶标結合以發揮它們的(de)治療效果和(hé)産生副作用(yòng),是藥物(wù)開發的(de)一個(gè)基本部分(fēn)。然而,針對(duì)藥物(wù)與靶标相互作用(yòng)的(de)研究傳統上涉及相對(duì)不精确的(de)方法,如對(duì)整個(gè)器官中的(de)藥物(wù)分(fēn)子濃度進行批量分(fēn)析。CATCH方法涉及将微小的(de)化(huà)學手柄插入到藥物(wù)分(fēn)子中。這(zhè)些獨特的(de)化(huà)學手柄不會與體内的(de)其他(tā)東西發生反應,但允許在藥物(wù)分(fēn)子與靶标結合後添加熒光(guāng)标簽。這(zhè)部分(fēn)上是因爲人(rén)類或動物(wù)組織傾向于擴散和(hé)阻擋來(lái)自這(zhè)些熒光(guāng)标簽的(de)熒光(guāng)Ye和(hé)他(tā)的(de)團隊将這(zhè)種标記過程與一種使組織相對(duì)透明(míng)的(de)技術相結合。在這(zhè)項初步研究中,這(zhè)些作者針對(duì)“共價藥物(wù)(covalent drug)”優化(huà)并評估了(le)他(tā)們的(de)方法,這(zhè)些藥物(wù)通(tōng)過稱爲共價鍵的(de)穩定化(huà)學鍵不可(kě)逆地與它們的(de)靶标結合。這(zhè)種不可(kě)逆的(de)結合使得(de)驗證這(zhè)類藥物(wù)是否結合了(le)它們的(de)預期靶标變得(de)尤爲重要。這(zhè)些作者首先評估了(le)大(dà)腦(nǎo)中一種叫做(zuò)脂肪酸酰胺水(shuǐ)解酶(FAAH)的(de)幾種共價抑制劑。FAAH抑制劑具有提高(gāo)包括“幸福分(fēn)子”花生四烯酸乙醇胺(anandamide)在内的(de)大(dà)麻素分(fēn)子水(shuǐ)平的(de)作用(yòng),目前正在研究如何治療疼痛和(hé)情緒失調。他(tā)們能夠在單細胞水(shuǐ)平上對(duì)這(zhè)些抑制劑在大(dà)塊小鼠腦(nǎo)組織中結合它們的(de)靶标的(de)位置進行成像,并能夠輕松地區(qū)分(fēn)它們的(de)不同的(de)靶标結合模式。
在一項實驗中,他(tā)們發現一種在2016年法國的(de)一項臨床試驗中造成了(le)一人(rén)死亡和(hé)數人(rén)受傷的(de)名爲BIA-10-2474的(de)實驗性FAAH抑制劑,即使在小鼠缺乏FAAH的(de)情形下(xià),也(yě)會與小鼠大(dà)腦(nǎo)中的(de)未知靶标結合,這(zhè)就爲這(zhè)種抑制劑的(de)毒性來(lái)源提供了(le)線索。
在展示這(zhè)種新方法前所未有的(de)精确性和(hé)多(duō)功能性的(de)其他(tā)測試中,這(zhè)些作者證實他(tā)們可(kě)以将藥物(wù)-靶标成像與單獨的(de)熒光(guāng)标記方法相結合來(lái)揭示藥物(wù)結合的(de)細胞類型。他(tā)們還(hái)可(kě)以在神經元的(de)不同部位區(qū)分(fēn)藥物(wù)-靶标的(de)結合位點。最後,他(tā)們可(kě)以觀察到适度不同劑量的(de)藥物(wù)往往會顯著影(yǐng)響不同大(dà)腦(nǎo)區(qū)域中的(de)靶标結合程度。Ye強調說,這(zhè)項原則性研究隻是一個(gè)開始。他(tā)和(hé)他(tā)的(de)團隊計劃進一步開發CATCH,以用(yòng)于更厚的(de)組織樣本,最終可(kě)能是整個(gè)小鼠。此外,他(tā)們還(hái)計劃将這(zhè)一基本方法擴展到更常見的(de)、非共價結合的(de)藥物(wù)和(hé)化(huà)學探針。Ye說,總的(de)來(lái)說,他(tā)設想這(zhè)種新方法不僅是藥物(wù)發現的(de)基本工具,甚至是基礎生物(wù)學的(de)工具。
核靶向AIE光(guāng)敏劑通(tōng)過光(guāng)動力及雙酶抑制用(yòng)于癌症治療
三苯胺結構具有雙光(guāng)子特性,經過功能性修飾或金屬配位可(kě)實現亞細胞器或生物(wù)分(fēn)子靶向,在生物(wù)醫藥,分(fēn)子探針等領域具有廣闊的(de)應用(yòng)前景。中山大(dà)學化(huà)學學院毛宗萬教授課題組從多(duō)維度對(duì)三苯胺骨架進行結構單元功能化(huà),取得(de)系統性研究成果。例如:開發了(le)二價鉑配位的(de)三腳架型人(rén)端粒G-四鏈體DNA穩定劑,實現了(le)端粒酶的(de)高(gāo)效抑制 (Nat. Commun., 2018, 9, 1-11); 設計了(le)對(duì)G-四鏈體DNA熒光(guāng)壽命選擇性響應的(de)三腳架陽離子探針,通(tōng)過熒光(guāng)壽命成像首次實現了(le)正常細胞和(hé)癌細胞的(de)可(kě)視化(huà)區(qū)分(fēn) (Angew. Chem. Int. Ed. 2020, 132, 9806-9813); 采用(yòng)線粒體膜和(hé)mtDNA雙色響應的(de)三苯胺骨架探針,通(tōng)過超分(fēn)辨成像技術首次追蹤并定義了(le)細胞脹亡的(de)精細過程 (Adv. Sci. 2021, 202004566)等。在此基礎上,近日,毛宗萬教授課題組聯合新加坡國立大(dà)學劉斌教授共同開發了(le)一種基于三苯胺結構的(de)核靶向光(guāng)敏劑(MeTPAE),MeTPAE不僅具有高(gāo)效ROS産率,其優異的(de)雙光(guāng)子吸收性質也(yě)爲其雙光(guāng)子光(guāng)動力治療提供了(le)便利。一方面,MeTPAE可(kě)以抑制核内組蛋白去乙酰化(huà)酶(HDACs)的(de)活性。另一方面由于其AIE特性,MeTPAE與核酸結合可(kě)以産生強熒光(guāng),以及穩定的(de)端粒G4DNA結合力。得(de)益于其優異的(de)ROS生成效率,MeTPAE可(kě)以有效地破壞核酸并抑制端粒酶活性。
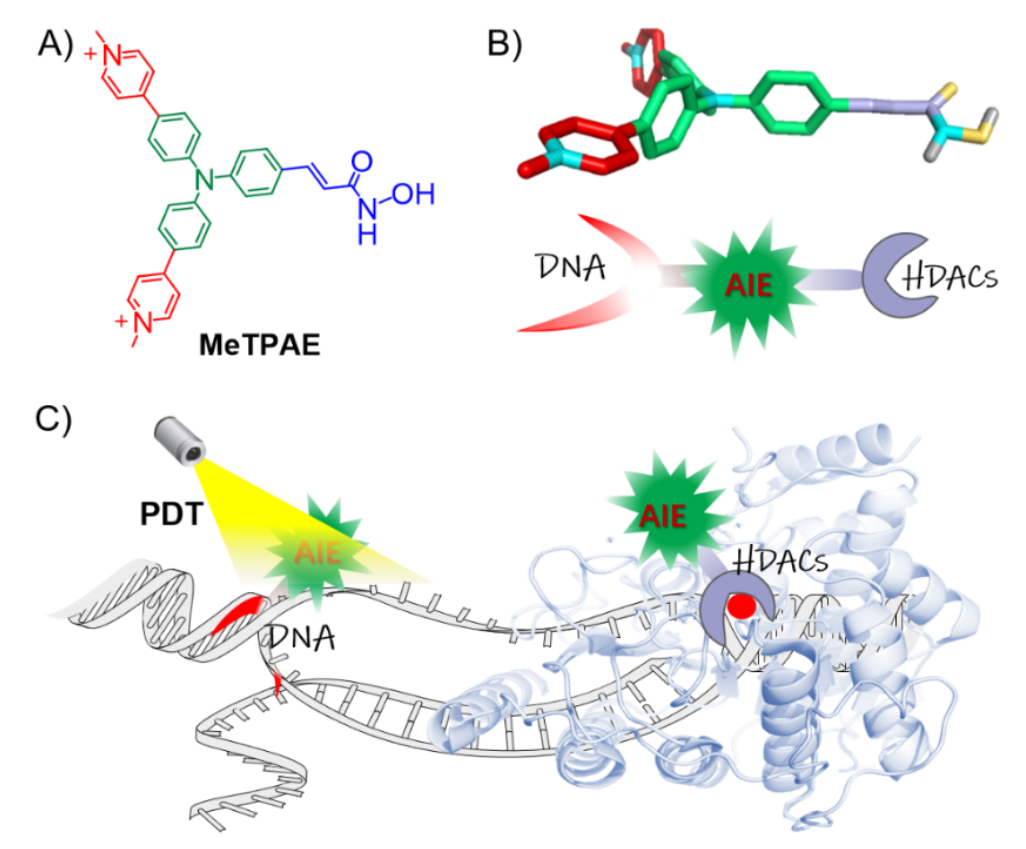
圖注:A: MeTPAE的(de)化(huà)學結構。B和(hé)C:MeTPAE 對(duì)核酸和(hé)組蛋白去乙酰酶(HDACs)的(de)雙重作用(yòng)示意圖。MeTPAE進入細胞核後,不僅可(kě)以與HDACs相互作用(yòng)抑制細胞增殖,還(hái)可(kě)以通(tōng)過PDT精确地破壞端粒和(hé)核酸。
實驗發現,MeTPAE可(kě)以對(duì)DNA,尤其是端粒G4DNA表現出敏感的(de)熒光(guāng)響應。MeTPAE不僅是一種有效的(de)光(guāng)激活端粒酶抑制劑(有效抑制率EC50爲 2.41 ± 0.10 μM);MeTPAE在光(guāng)照(zhào)條件下(xià)也(yě)具有有效的(de)DNA切割活性。使用(yòng)商業化(huà)檢測試劑盒對(duì)分(fēn)子的(de)HDACs的(de)抑制活性進行評價,結果發現MeTPAE具有與FDA批準的(de)抑制劑(SAHA,romidepsin和(hé)panobinostat)相似的(de)HDACs抑制活性,這(zhè)爲MeTPAE的(de)抗腫瘤能力提供了(le)基礎。通(tōng)過共聚焦成像的(de)單/雙光(guāng)子通(tōng)道可(kě)以同時(shí)檢測到MeTPAE不斷富集于細胞核,并可(kě)用(yòng)于追蹤細胞的(de)有絲分(fēn)裂過程。在黑(hēi)暗條件下(xià),相比于HeLa細胞,人(rén)的(de)原代正常成纖維細胞具有更高(gāo)的(de)存活率;在光(guāng)照(zhào)條件下(xià),MeTPAE可(kě)以通(tōng)過光(guāng)動力方式更顯著地殺傷腫瘤細胞。該工作通(tōng)過開發能夠細胞核靶向的(de)藥物(wù)分(fēn)子,并将分(fēn)子單元官能化(huà)實現了(le)單分(fēn)子多(duō)途徑 (腫瘤細胞端粒酶抑制,組蛋白去乙酰化(huà)抑制劑以及雙光(guāng)子光(guāng)動力(PDT) )的(de)癌症治療,爲惡性腫瘤的(de)高(gāo)效治療提供了(le)新途徑。相關研究成果以“A Nuclear‐Targeted AIE Photosensitizer for Enzyme Inhibition and Photosensitization in Cancer Cell Ablation”爲題發表在Angewandte Chemie International Edition,并被選作Hot Paper文章(zhāng)。毛宗萬教授和(hé)新加坡國立大(dà)學劉斌教授爲共同通(tōng)訊作者,化(huà)學學院的(de)博士畢業生王康男(nán)爲第一作者,中山大(dà)學化(huà)學學院爲本成果的(de)第一通(tōng)訊單位。該工作得(de)到國家自然科學基金、中央高(gāo)校基本科研業務費,生物(wù)無機與合成化(huà)學教育部重點實驗室的(de)大(dà)力支持。
文章(zhāng)轉載自生物(wù)谷,系出于傳遞更多(duō)信息之目的(de),轉載内容不代表本站立場(chǎng)。如有侵權請及時(shí)聯系,我們将立即進行删除處理(lǐ)。
返回列表